 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
为确定某溶液的离子组成,进行如下实验:①测定溶液的pH,溶液显强碱性。②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验以下推测正确的是()
A.一定有SO32-离子
B.一定有CO32-离子
C.一定有C1—离子
D.不能确定HCO3-离子是否存在
 答案
答案
B、一定有CO32-离子





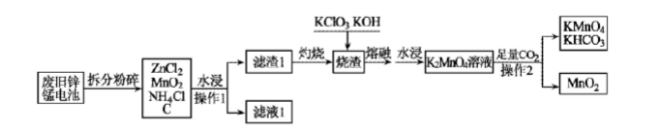 (1)K+的结构示意图为()。
(1)K+的结构示意图为()。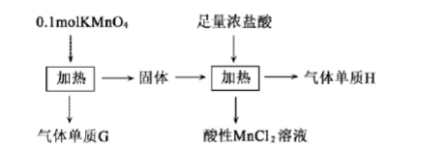 A、G与H均为氧化产物
A、G与H均为氧化产物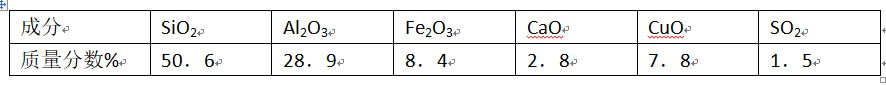 问题一、上述氧化物中能与水反应的是()。
问题一、上述氧化物中能与水反应的是()。
 问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。
问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。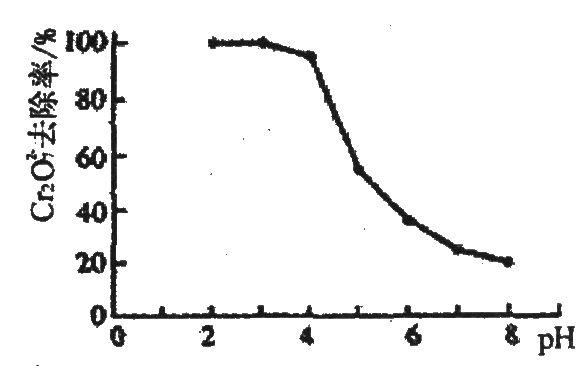
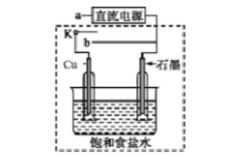 ①当开关K与a连接时,两极均有气泡产生,则阴极为()电极。
①当开关K与a连接时,两极均有气泡产生,则阴极为()电极。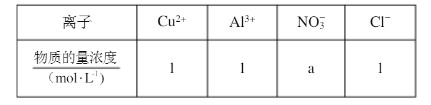 用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积变化及电极产物可能存在的溶解现象),下列说法正确的是()(填字母)。
用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积变化及电极产物可能存在的溶解现象),下列说法正确的是()(填字母)。
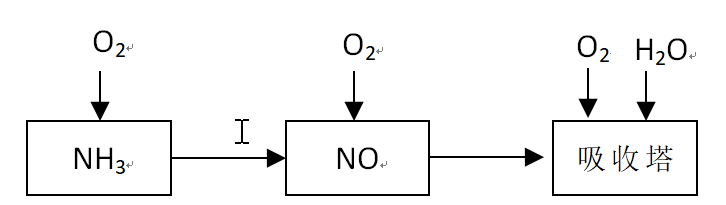 某课外小组模拟上述部分过程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)。
某课外小组模拟上述部分过程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)。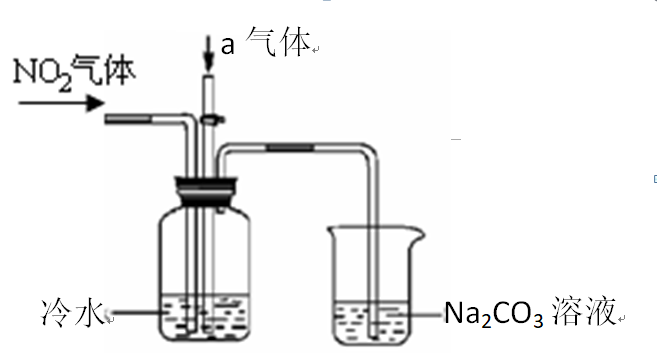
 N2O4(g)的平衡常数K=()。假设NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为()。
N2O4(g)的平衡常数K=()。假设NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为()。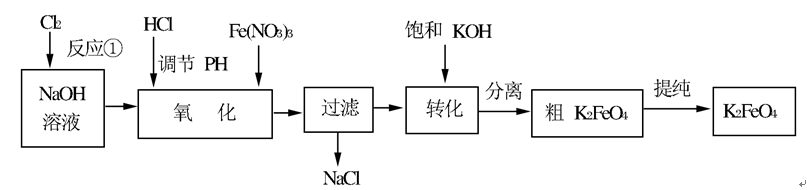 问题一、写出反应①的离子方程式()。
问题一、写出反应①的离子方程式()。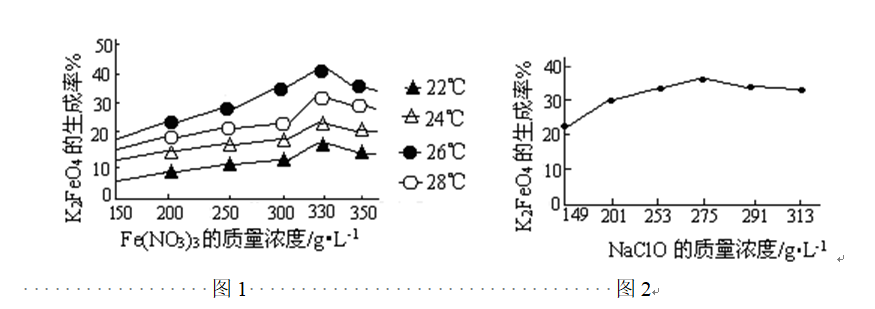
 4Fe(OH
4Fe(OH



















