 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
25℃时,AgCl的溶解度为1.92×10g/L,AgCl的摩尔质量为143.3g/mol,该温度下AgCl的溶度积是()-10-20-10。
A.1.92×10
B.1.0×10
C.1.80×10
D.-6
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.1.92×10
B.1.0×10
C.1.80×10
D.-6
 答案
答案
 更多“25℃时,AgCl的溶解度为1.92×10g/L,AgCl的摩尔质量为143.3g/mol,该温度下AgCl的溶度积是()-10-20-10。”相关的问题
更多“25℃时,AgCl的溶解度为1.92×10g/L,AgCl的摩尔质量为143.3g/mol,该温度下AgCl的溶度积是()-10-20-10。”相关的问题
第1题
25℃时AgCl在纯水中的溶解度为1.34×10-5mol/L,则该温度下AgCl的Ksp值为()。
A.8.8×10-10
B.5.6×10-10
C.3.5×10-10
D.1.8×10-10
第3题
A.标准滴定溶液是Ag2CrO4溶液
B.指示剂为铬酸钾
C.gCl的溶解度比Ag2CrO4的溶解度小,因而终点时Ag2CrO4(砖红色〉转变为AgCl (白色〉
D.n(Cl-)=n(Ag+)
第4题
A.在溶液中加入一定量的KNO3溶液,难溶电解质溶解度增加
B.当某条件下IP=Ksp时,表示溶液是饱和的,沉淀和溶解达到动态平衡
C.在溶液中加入少量的NaCl溶液,可使溶解度减少
D.根据溶度积规则,沉淀生成条件是IP>Ksp
E.一定温度下,对于不同类型的难溶电解质来说,Ksp越大,溶解度越大
F.难溶性电解质在水溶液中都无法解离G、AgCl水溶液的导电性很弱,所以AgCl为弱电解质
第5题
温度为25℃、总压为101.3kPa时,查得CO2的亨利系数E=14.39×104kPa。试计算:
(1) 溶解度系数H及相平衡常数m的值(对稀水溶液ρ=998kg·m-3);
(2) 若CO2在空气中的分压为10.13kPa,求与其成平衡的水溶液浓度,分别以摩尔分数和kmol·m-3表示。
第6题
A.AgCl和Ag2CrO4的溶解度可由两者溶度积求得
B.AgCl和Ag2CrO4两者类型不同,不能用溶度积直接比较溶解度大小
C.AgCl溶解度大于Ag2CrO4
D.AgCl和Ag2CrO4都是难溶盐
E.AgCl和Ag2CrO4两者的IP大于各自溶度积时开始沉淀
F.向有[Cl-]、[CrO42-]存在的溶液中逐滴加硝酸银溶液,AgCl先出现
第7题
将反应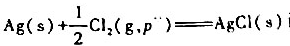 设计成原电池.已知25°C;时,
设计成原电池.已知25°C;时,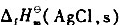 =-127.07kJ.mol-1.
=-127.07kJ.mol-1.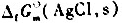 =-109.79kJ.mol-1,标准电极电势
=-109.79kJ.mol-1,标准电极电势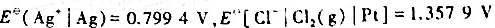 .
.
(1)写出电极反应和电池图示;
(2)求25°C、电池可逆放电2F电荷悬时的热Qz;
(3)求25°C时AgCl的活度积Kap.
第8题
A.pH高时,AgCl的溶解度太大
B.pH高时,Ag2CrO4易分解
C.pH高时,Ag2CrO4转化为AgCl的速度太慢
D.pH高时,Ag+容易水解
第9题
A.0.799
B.0.360
C.0.675
D.0
第10题
比较AgCl在6mol·L-1氨水和水中的溶解度。已知KSP(AgCl)=1.8×10-10,KSP{[Ag(NH3)2]+}=1.12×107。