 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在温度T时,若电池反应Cu+Cl2===Cu2++Cl的标准电池电动势为E1,Cu+Cl2===Cu2++2Cl的标准电池电动势为E2,则E1和E2的关系为:()。
A.E1/E2=2
B.E1/E2=1/2
C.E1/E2=4
D.E1/E2=1
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.E1/E2=2
B.E1/E2=1/2
C.E1/E2=4
D.E1/E2=1
 答案
答案
 更多“在温度T时,若电池反应Cu+Cl2===Cu2++Cl的标准电池电动势为E1,Cu+Cl2===Cu2++2Cl的标准电池电动势为E2,则E1和E2的关系为:()。”相关的问题
更多“在温度T时,若电池反应Cu+Cl2===Cu2++Cl的标准电池电动势为E1,Cu+Cl2===Cu2++2Cl的标准电池电动势为E2,则E1和E2的关系为:()。”相关的问题
第1题
用波长为313nm的单色光照射气态丙酮,发生下列分解反应:
(CH3)2CO(g)+hν→C2H6(g)+CO(g)
若反应池的容量是0.059dm3,丙酮吸收入射光的分数为0.915,在反应过程中,得到下列数据:
反应温度840K 照射时间t=7.0h
起始压力102.16kPa 入射能48.1×10-4J·s-1
终了压力104.42kPa
计算此反应的量子效率。
第2题
已知铅酸蓄电池
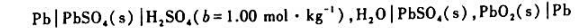
在25°C时的电动势E=1.9283V,Eθ=2.0501V.该电池的电池反应为
Pb(s)+PbO2(s)+2SO42-+4H+→2PbSO4(s)+2H2O
(1)请写出该电池的电极反应;
(2)计算该电池中硫酸溶液的活度a、平均离子活度az及平均离子活度因子γz;
(3) 已知该电池的温度系数为5.664x10-5V·K-1,计算电池反应的ΔrGm,ΔrSm,ΔrHm,
及可逆热Qr,m.
第5题
问题1、1840年Devil用干燥的氧气通过干燥的硝酸银,得到N2O5,该反应的氧化产物是一种参与大气循环的气体,写出该反应的化学方程式()。
问题2、F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应
2N205(g)→4NO2(g)+O2(g)+Q1(Q1<0),2NO2(g) N204(g)+Q2(Q2>0)
N204(g)+Q2(Q2>0)
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强P随时间t的变化如下表所示(t=00时,N2O5(g)完全分解);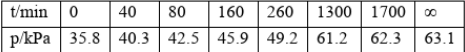
①究表明,N2O5(g)分解的速率v=2x10-3Xpn2o5(kPa'min)。t=62min时,测得体系Po2=2.9kPa,则此时PN2O5:=()kPa,v=()(kPa/min)。
②若提高反应温度至35℃,则N2O5(g)完全分解后体系压强P00(35℃)()63.1kPa(填“大于”、“等于”或“小于”),试从勒夏特列原理的角度加以解释()。
③写岀N2O4(g) 2NO2(g)反应的平衡常数表达式()。
2NO2(g)反应的平衡常数表达式()。
问题3、对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步:N2O5 NO2+NO3快速平衡
NO2+NO3快速平衡
第二步NO2+NO3→NO+NO2+O2慢反应
第三步NO+NO3→2NO2快反应
其中可近似认为第二步反应不影响第一步的平渐。下列表述错误的是()(填编号),
A.v(第一步反应的逆反应)>v(第二步反应)B.反应的中间产物只有NO3
C、该反应的速率主要由第二步决定D.N2O5的分解率主要由第一步决定
第7题
在673K时,设反应NO2(g)====NO(g)+ O2(g)可以进行完全,并设产物对反应速率无影响,经实验证明该反应是二级反应,速率方程可表示为
O2(g)可以进行完全,并设产物对反应速率无影响,经实验证明该反应是二级反应,速率方程可表示为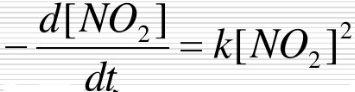
速率常数k与温度T之间的关系为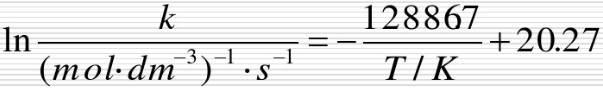

第8题
已知反应CaO(s)+SO3(g)====CaSO4(s)在298.15K时△rHm=-402.0kJ·mol-1,△rHm=-345.7kJ·mol-1,估算该反应在100kPa,当ΔG(T)=0时的温度T,并简述向燃烧高含硫量煤的炉中投入生石灰CaO可除去SO3、减少大气污染的理由。
第9题
在600K时,某化合物分解反应的速率常数k=3.3×10-2s-1,反应的活化能Ea=18.88×104J·mol-1,若控制反应在10min内转化率达90%,则反应的温度应控制为多少?
第10题
电池Zn|ZnCl2(0.05mol·kg-1)|AgCl(s)|Ag(s)的电动势与温度的关系为E/V=1.015-4.92×10-4(R/K-298)。试计算在298K,当电池有2mol电子的电荷量输出时,电池反应的△rGm、△rHm、△rSm和此过程的可逆热效应QR。
第11题